Hereditært angioødem-legemiddel FDA-godkjent
Den amerikanske legemiddelmyndigheten (FDA) har godkjent BioCrysts orale berotralstat (ORLADEYO) for profylakse mot angrep av den arvelige sykdommen hereditært angioødem.
Denne artikkelen er mer enn fem år gammel.
Berotralstat er godkjent som en oral, en daglig dose behandling hos voksne og unge over tolv år.
Arvelig
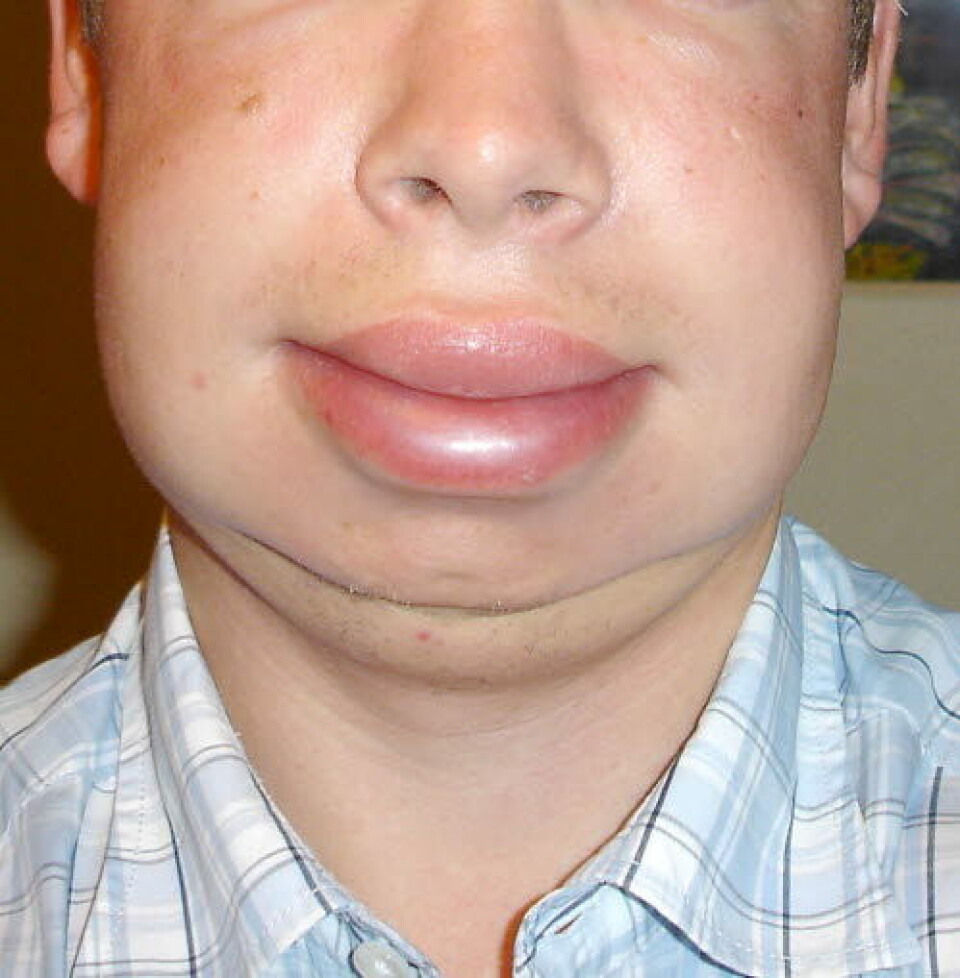
Hereditært angioødem (HAE) er en arvelig sykdom hvor pasientene får anfall med hevelser i hud og slimhinner. Sykdom som skyldes en genetisk svikt i komplementsystemet. Pasienter med sykdommen mangler fungerende C1-esteraseinhibitor, et protein som fungerer som en bremsekloss når komplementsystemet aktiveres. Lette slag og skader kan i denne pasientgruppen gi store hevelser (Kilde: Store norske leksikon).
Godkjenningen er basert på fase 3-studien APeX-2, hvor det ble observert at anfall etter 24 uker, en reduksjon som ble opprettholdt gjennom 48 uker. Pasienter som fullførte 48 ukers behandling (150 mg) så reduksjon i angrepsfrekvensen, fra et gjennomsnitt på 2,9 angrep per uke til 1,0 per uke. I den langsiktige, open-label-studien APeX-S-studien ble det funnet at hos pasienter som fullførte 48-ukers behandling så man en gjennomsnittlig angrepsfrekvens på 0,8 per uke.
Reduksert standard-behandling
I studiene så man at berotralstat var trygg og godt tolerert. Vanligste rapporterte bivirkning, sammenlignet med placebo var gastrointestinale reaksjoner, som vanligvis oppstod tidlig etter initiering av behandling, men som ble sjeldnere etter hvert.
– Berotralstat er første oralt administrerte ikke-stereoide alternativ til å forhindre HAE-angrep og er et viktig steg i flere behandlingsalternativ for leger og pasienter, uttalte Anthony Castaldo, president i den amerikanske hereditært angioødem-forening (HAEA), i en pressemelding.
I tillegg til redusert angrepsfrekvens viste studiene at pasientene hadde en signifikant reduksjon i standard-behandling ved bruk av berotralstat.























































