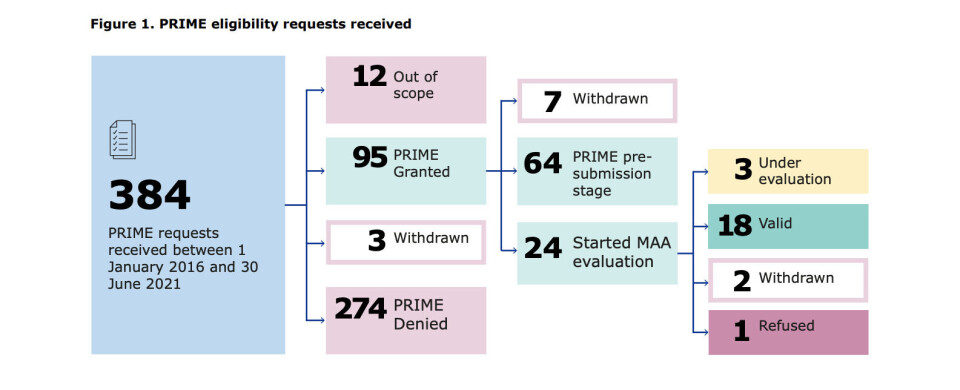
UTVIKLING: Grafen fra EMA-rapporten viser antallet forespørsler om PRIME-støtte mellom mars 2016-juni 2021 (384, frem til antallet legemidler med PRIME-status som fikk markedsføringstillatelse i EU (18). Foto: Skjermdump fra EMA-rapport.
Foto:Slik vurderer EMA PRIME-ordningen etter fem år
En ny rapport om Priority Medicines (PRIME)-ordningen viser blant annet at tiden frem til markedsføringstillatelse ble redusert for medisinene som fikk fordeler fra PRIME.
Denne artikkelen er mer enn tre år gammel.
Det europeiske legemiddelbyrået EMA publiserte torsdag 3. mars en rapport som presenterer resultatene fra de første fem årene med PRIME. Ordningen ble lansert i mars 2016.
Målet med PRIME var å støtte opp under utviklingen av medisiner som var forventet å hjelpe pasienter som ikke hadde eksisterende behandlingsmuligheter, eller tilby stor terapeutisk fordel over eksisterende terapier. Ordningen tilbød tidlig og utvidet vitenskapelig og regulatorisk støtte til lovende medisiner.
18 PRIME-medisiner ble godkjent
Rapporten fra EMA har tatt for seg perioden fra mars 2016 til juni 2021. I løpet av denne perioden ble 18 legemidler som fikk PRIME-støtte EU-godkjent. Ti av disse fikk såkalt betinget markedsføringstillatelse, som muliggjorde tidligere markedstilgang og tidligere tilgang for pasienter. Syv av de 18 legemidlene var såkalte avanserte terapier (ATMP-er), som mulig kunne omforme behandlingen av en rekke sykdommer og tilstander. 16 av medisinene omhandlet sjeldne sykdommer. PRIME-medisiner har blant annet inkludert CAR-T-cellleterapier, engangs kurative genterapier, behandlinger for sjeldne kreftsykdommer og en vaksine mot ebolaviruset.
Ved tidspunktet rapporten ble publisert hadde totalt 98 legemidler blitt akseptert inn i PRIME-ordningen. Dette inkluderte den første akademia-ledede legemiddelutviklingen, som er en ATMP som utvikles som behandling av relapsert eller refraktorisk lymfoblastisk leukemi i voksne over 25 år.
– Alle akademiske utviklere oppfordres til å interagere med regulatoriske myndigheter for å få tilgang til tidlig støtte for utvikling og klinisk utvikling av deres produkter, skriver EMA i en artikkel på egne nettsider.
Peker på forbedringsområder
EMA-rapporten peker også på flere ting som kan forbedre ordningen. Dette inkluderer bedre timing for når et legemiddel blir med i PRIME-ordningen, fleksibilitet rundt de vitenskapelige rådgivningsprosedyrene samt bedre bruk av kunnskapen som bygger seg opp under legemiddelutviklingen for mer robuste søknader om markedsføringstillatelse (MT), og som igjen kan bli vurdert hurtigere.
EMA fullfører for tiden en «verktøykasse» med råd for utviklere av medisiner som støttes av PRIME-ordningen. Retningslinjene skal etter planen hjelpe utviklere med å generere robuste kvalitetasdata-pakker for MT-søknader i EU.























































