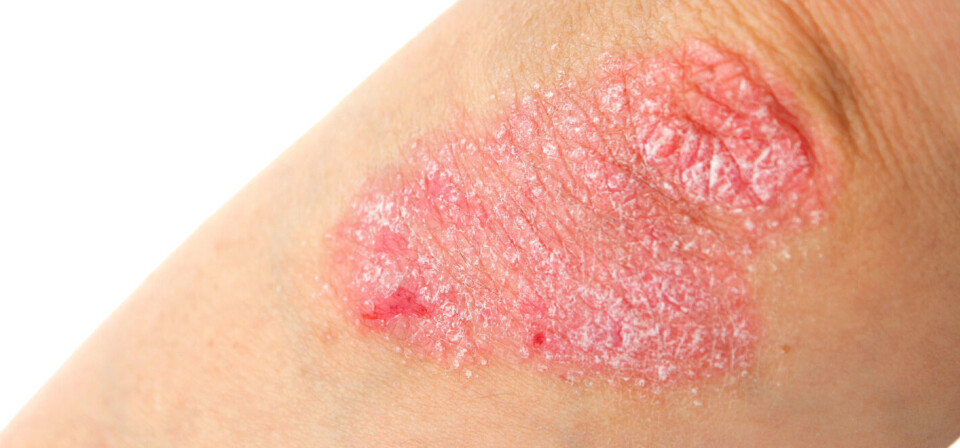
EU-godkjennelse til psoriasis-legemiddel
Nytt Janssen-medikament klart for det europeiske markedet.
Denne artikkelen er mer enn fem år gammel.
EU-kommisjonen har godkjent legemiddelet guselkumab (Tremfya) fra Janssen, kunngjorde selskapet torsdag. Medikamentet er godkjent til å behandle moderat til alvorlig plakkpsoriasis. Dette er ifølge selskapet det første biologiske legemiddelet som selektivt blokkerer interleukin-23 – et protein som står sentralt i utviklingen av inflammasjon hos psoriasispasienter.
Godkjennelsen er basert på data fra to pågående fase 3-studier VOYAGE 1 og VOYAGE 2, hvor guselkumab er sammenlignet med AbbVie-medikamentet adalimumab (Humira). I tillegg er den basert på NAVIGATE-studien hvor medikamentet er gitt til pasienter som er byttet over fra Janssens eget ustekinumab (Stelara) ved manglende effekt etter 16 uker. Guselkumab er dessuten under utprøving i en studie der det sammenlignes med Novartis’ legemiddel sekunimumab (Cosentyx).
Helseforetakenes Bestillerforum ga i august Statens legemiddelverk i oppdrag å gjøre en hurtig metodevurdering av medikamentet.























































